2020年5月21日,杭州纽安津生物科技有限公司与浙江大学附属邵逸夫医院肿瘤内科通过数年的临床合作,在国际上率先发表了首个新生抗原个体化多肽疫苗单药治疗泛癌种晚期实体瘤患者的临床试验。该药物为团队自主研发的iNeo-Vac-P01,临床试验结果显示患者疾病控制率高,且明显延长患者生存期。相关成果已在国际顶尖临床医学期刊Clinical Cancer Research发表——A pan-cancer clinical study of personalized neoantigen vaccine monotherapy in treating patients with various types of advanced solid tumors。
https://clincancerres.aacrjournals.org/content/early/2020/05/21/1078-0432.CCR-19-2881

本项临床研究入组了22例标准治疗失败的泛癌种晚期实体瘤患者,基于高通量测序数据,利用iNeo人工智能疫苗设计平台、个体化多肽药物制备及质控体系为每一位患者定制了个体化多肽疫苗iNeo-Vac-P01,经多次皮下注射后,通过免疫响应、肿瘤负荷监测等技术平台为其提供了全面的随访监测。
90.9%的受试者均无严重不良反应;38.1%的受试者病灶在新生抗原多肽疫苗治疗过程中出现缩小,最大缩少比例为16.7%;证明了个体化疫苗的安全有效。
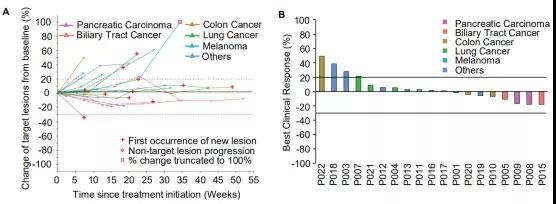
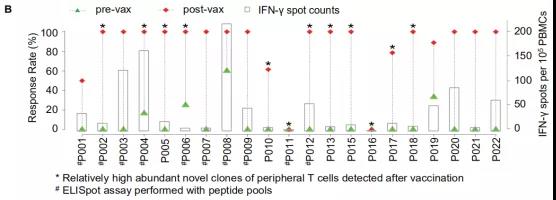
患者治疗后外周血免疫细胞的ELISpot实验证明,80%的iNeo-Vac-P01多肽疫苗激发了抗原特异性的免疫响应,证明了iNeo人工智能平台对新生抗原筛选的准确性及疫苗设计的有效性。
此外,通过患者治疗前后的全景免疫组化显示,肿瘤浸润淋巴细胞数量及比例,特别是激活的CD8+T细胞和CD4+T细胞均有大幅提高,证明了iNeo-Vac-P01多肽疫苗明显改善了肿瘤免疫微环境,让冷肿瘤变成热肿瘤。
2例案例报告
案例报告一,患者005,63岁,男,晚期胆管癌。
2013年首次被诊断为肝内胆管癌;
2013年6月进行手术切除;
2014年4月术后化疗;
2017年4月CT复查确认肿瘤复发、转移;
2017年5月至11月阿帕替尼靶向治疗;
2017年11月起,参加PD-1临床试验((IBI308),接受PD-1治疗6个周期,因疾病进展而退出临床试验;
2018年3月底,患者入组浙江大学医学院附属邵医医院接受个体化新生抗原多肽疫苗iNeo-Vac-P01,截止2019年5月共进行11次注射;
2018年8月,CT复查发现靶病灶最大直径122.9 mm,与基线期(89.1 mm)相比明显增大;
2019年1月,CT再次复查发现靶病灶最大直径75.4 mm,肿瘤大小与 PD(122.9mm)相比缩小38.6%。患者在接受个体化新生抗原多肽疫苗iNeo-Vac-P01治疗过程,出现了一次免疫治疗的典型假性进展情况。在治疗过程中,观察到免疫学相关的疗效反应,与基线期相比,患者治疗后外周血中INF-γ的分泌明显增加,肿瘤组织周围浸润的活化CD8+ T细胞和活化CD4+ T细胞别增加11.9倍和7.3倍。
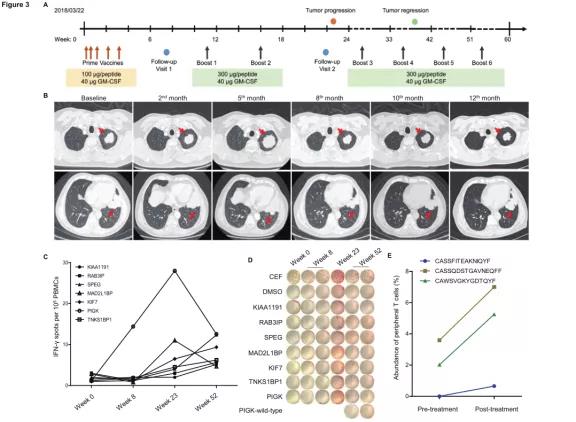
患者005的个体化肿瘤疫苗注射过程及疗效反应
案例报告二,患者008,65岁,女,晚期胰腺癌。
2016年07月19日首次诊断为胰腺癌;
2016年07 月 25日行“胰体尾+脾脏切除术”,术后病理“胰体尾中低分化腺癌”。术后完成6个周期的吉西他滨单药化疗;
2017年6月28日复查上腹部磁共振(MRI)增强扫描显示肝转移瘤复发;
2017年7月6日,接受化疗和射频消融术(RFA)治疗肝转移;
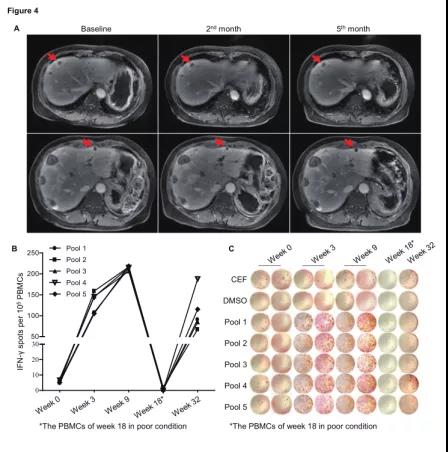
2018年4月6日接受个体化新生抗原多肽疫苗iNeo-Vac-P01第一次注射;
治疗后2个月和治疗后4个月的影像评估显示,与基线期相比,肝脏转移病灶明显缩小。患者治疗后外周血中INF-γ的分泌显著增加。该患者的体外ELISpot实验显示患者治疗前外周血中有特异性的INF-γ干扰素分泌,提示既往射频消融可能导致肿瘤新生抗原释放, 治疗后肿瘤组织周围浸润的活化CD8+ T细胞和活化CD4+ T细胞均显著增加,分别增加了54.6%和66.4% 。
本研究为全球首次针对泛癌种标准治疗失败的晚期实体瘤患者的新生抗原多肽疫苗治疗临床试验,并且不同于国外联用PD-1抑制剂的临床方案,通过新生抗原多肽疫苗(iNeo-Vac-P01)的单药治疗,充分证明了团队自主研发的iNeo-Vac-P01的有效性及安全性。该研究成果将加速基于新生抗原的精准免疫治疗研究,推动免疫治疗进入定制化的2.0时代。

